Una solución, es una mezcla de
dos o más componentes, perfectamente homogénea ya que cada componente se mezcla
íntimamente con el otro, de modo tal que pierden sus características
individuales. Esto último significa que los constituyentes son indistinguibles
y el conjunto se presenta en una sola fase bien definida.
 |
| Niveles de concentración de las soluciones |
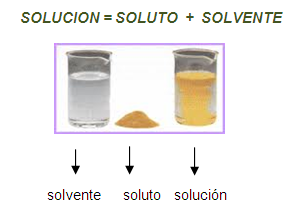
Características de las soluciones:
 |
| Componentes de las soluciones |
I) Sus componentes no pueden
separarse por métodos físicos simples como decantación, filtración,
centrifugación, etc.
II) Sus componentes sólo pueden
separase por destilación, cristalización, cromatografía.
III) Los componentes de una
solución son soluto y solvente.
Soluto es aquel componente que se encuentra
en menor cantidad y es el que se disuelve.
Solvente es aquel componente que
se encuentra en mayor cantidad y es el medio que disuelve al soluto.
IV) En una disolución, tanto el
soluto como el solvente interactúan a nivel de sus componentes más pequeños
(moléculas, iones). Esto explica el carácter homogéneo de las soluciones y la
imposibilidad de separar sus componentes por métodos mecánicos.
Por su concentración pueden ser:
Las disoluciones son mezclas de
dos o más sustancias, por lo tanto se pueden mezclar agregando distintas
cantidades: Para saber exactamente la cantidad de soluto y de solvente
de una disolución se utiliza una
magnitud denominada concentración.
Dependiendo de su concentración,
las disoluciones se clasifican en diluidas, concentradas, saturadas, sobresaturadas.
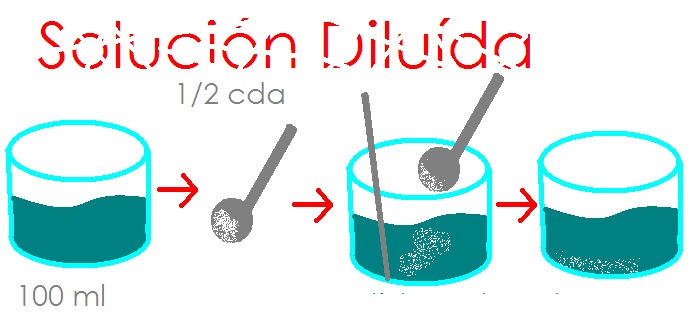
Diluidas:
Si la cantidad de soluto respecto del solvente es
pequeña. Ejemplo: una solución de 1 gramo de azúcar en 100 gramos de
agua. Es decir, contiene pequeña cantidad de soluto, en un volumen determinado.
Concentradas:
Si la proporción de soluto con respecto del solvente es
grande. Pero aún se logra diluir. Ejemplo:
una disolución de 25 gramos de sal de mesa
en 100 gramos de
agua.
 |
| Solución concentrada |
Saturadas:
Se dice que una disolución está saturada a una determinada
temperatura cuando no admite más cantidad de soluto disuelto. (Ya no se
disuelve más a esa temperatura).
| Comparación de solución diluida con una saturada |
Sobresaturadas:
Disolución que contiene mayor cantidad de soluto que la
permitida a una temperatura determinada. La sobresaturación se produce por
enfriamientos rápidos o por descompresiones bruscas, es inestable y se
precipita fácilmente.
 |
| Solución sobresaturada |
Unidades físicas deconcentración.
Las unidades físicas de concentración están expresadas en
función del peso y del volumen, en forma porcentual, y son las siguientes:
a) Tanto por ciento peso/peso %P/P = (cantidad de gramos de
soluto) / (100 gramos de solución)
b) Tanto por ciento volumen/volumen %V/V = (cantidad de cc
de soluto) / (100 cc de solución)
c) Tanto por ciento peso/volumen % P/V = (cantidad de gr de
soluto)/ (100 cc de solución).
* Regla para calcular disoluciones o concentraciones
V1 • C1 =
V2 • C2
Unidades químicas deconcentración.
Para expresar la concentración de las soluciones se usan
también sistemas con unidades químicas, como son:
·
Fracción molar
·
Molaridad M = (número de moles de soluto) / (1
litro de solución)
·
Molalidad m = (número de moles de soluto) / (1
kilo de solvente)
- Actividades:
- Hacer un cuadro comparativo de las diferentes soluciones.
- Hacer una ficha de trabajo donde anoten las unidades de concentración.
- Ver el vídeo anexado, y realizar un resumen.
Las mezclas homogéneas es un tema de mucha importancia desde en nivel básico como en nivel Licenciatura, para poder conocer los tipos de soluciones que existen, y no solo verlo como teórico, sino como practico para que puedan apreciar y corroborar sus resultados.
ResponderEliminarV I D E O
ResponderEliminarEL VÍDEO MUESTRA UN VASO CON AGUA EN 3 DIFERENTES MOMENTOS, EL PRIMERO SE AGITA CON UN POCO DE MINERAL CRISTALIZADO, POSIBLEMENTE SAL O AZUCAR, EL SEGUNDO CON MAS Y EL TERCERO CON MAS, LO OBSERVABLE DEVELA QUE CAMBIA LA COLORACIÓN DEL AGUA.
como se puede calcular las soluciones saturadas y sobresaturadas
ResponderEliminar