El enlace intermolecular es la unión que como resultado de las fuerzas de carácter electrostático que se establecen entre las moléculas, consigue mantenerlas unidas en una red cristalina.
Aunque hay diferentes tipos de fuerzas intermoleculares, tal como se muestra a continuación, todas ellas tienen mucha menor fortaleza que un enlace iónico o covalente
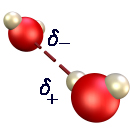
 |  | | F | | Enlace de hidrógeno: Enlace que se establece entre un átomo de H de una molécula, que por ir unido a F, O ó N (los 3 átomos más electronegativos) tiene una gran densidad de carga positiva, y unátomo de F, O ó N de otra molécula que tendrá una gran densidad de carga negativa: |
| | | |
|
| | | | |
| | F | | Fuerzas de Van der Waals: |
| | | | Dipolo permanente - dipolo permanente |
| | | |
| 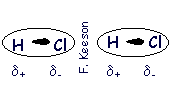 |
| (Polar- Polar) | | |
|
|
| | | | |
| | | | Dipolo permanente - dipolo inducido |
| | | |
| 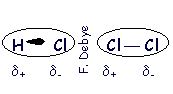 |
| (Polar- Apolar) | | |
|
|
| | | | |
| | | | Dipolo instantáneo - dipolo inducido (fuerzas de dispersión) |
| | | |
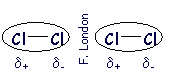 | (Apolar- Apolar) |
| Una molécula no polar puede experimentar un ligero desplazamiento de su nube electrónica y formar un dipolo instantáneo, que induce otro dipolo en una molécula próxima. Ambos dipolos se atraen. |
|
| | | | |
| | | | Dentro de cada tipo de Fuerza de Van der Waals, la intensidad aumenta con la superficie de la molécula; es decir, con el tamaño (que en general, aunque no siempre, va unido al peso molecular). |

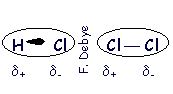
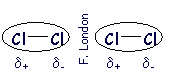
ESTE SI SE PUEDE LEER PERO DA FLOJERA =(
ResponderEliminarmuy buen tema compañera, creo que este material es excelente para que los alumnos lo puedan tener de apoyo para llegar a una mejor compresión. felicidades compañera.
ResponderEliminar